Atomística
•Número atômico de um átomo (Z): é o Nº de prótons (de cargas positivas) que há no seu núcleo. Um átomo é diferente de outro pelo valor de Z (Z=E).
•Número de massa de um átomo (A): é a quantidade de núcleons em um átomo. Núcleons são prótons e nêutrons (A=P+N).
•Para representar o número de prótons, nêutrons e elétrons de uma espécie :
Num átomo, o no de prótons é igual ao no de elétrons. O átomo é eletricamente neutro.
Um íon é um átomo desequilibrado eletricamente, ou seja, o no de elétrons não é igual ao de prótons como ocorre num átomo (ou numa molécula). O ânion tem excesso de elétron(s), sendo íon negativo. O cátion tem carência de elétron(s), sendo íon positivo.
Os átomos são eletricamente neutro, quando possuem a mesma quantidade de prótons e elétrons.
Prótons: partícula de carga positiva (+)
Elétrons: partícula de carga negativa (-)
Nêutrons: partícula sem carga
Z = E = P
Os íons são átomos neutros que perderam ou ganharão elétrons.
Um íon é um átomo desequilibrado eletricamente, ou seja, o no de elétrons não é igual ao de prótons como ocorre num átomo (ou numa molécula). O ânion tem excesso de elétron(s), sendo íon negativo. O cátion tem carência de elétron(s), sendo íon positivo.
Os átomos são eletricamente neutro, quando possuem a mesma quantidade de prótons e elétrons.
Prótons: partícula de carga positiva (+)
Elétrons: partícula de carga negativa (-)
Nêutrons: partícula sem carga
Z = E = P
Os íons são átomos neutros que perderam ou ganharão elétrons.
ISÓTOPOS, ISÓBAROS, ISOTONOS E ISOELETRONICOS:
Isótopos são átomos (ou íons) de um mesmo elemento com diferentes números de massa e o mesmo Nº de prótons.
Isóbaros são átomos (ou íons) de elementos diferentes com o mesmo número de massa.
Isótonos são átomos (ou íons) de elementos diferentes com o mesmo número de nêutrons.
Espécies isoeletrônicas são átomos, moléculas, ou íons com o mesmo número de elétrons.
- Sobre as representações abaixo,
- Analise os itens corretos.
0 0 - I e VI são isótopos, apresentam o mesmo número de elétrons, mas não têm a mesma quantidade de nêutrons.
1 1 - I e II têm o mesmo número de prótons e de elétrons.
2 2 - Embora sejam isótopos isoeletrônicos,
II e IV não têm a mesma massa atômica.
3 3 - III e V, que não têm o mesmo número
de nêutrons, apresentam menor quantidade
de elétrons que o átomo IV.
4 4 - II e IV não têm o mesmo número de nêutrons nem a mesma massa atômica.














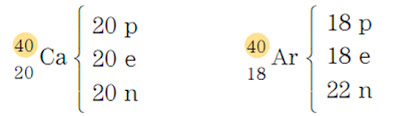





 Posted in:
Posted in: 



