Ligações Química
1. Introdução
.Estabilidade dos gases nobres: possuem a última camada com oito elétrons, com exceção do hélio que tem dois.
.Teoria do Octeto: um grande número de átomos adquire estabilidade eletrônica quando apresenta oito elétrons na última camada.
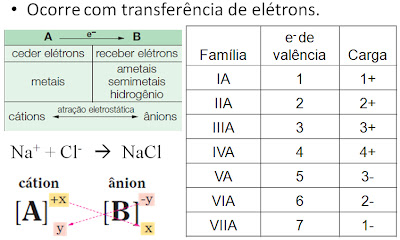
Ligação Iônica ou eletrovalente
Características dos compostos iônicos
. Retículo cristalino: aglomerados de íons com forma geométrica definida
a)sólidos a temperatura ambiente;
b)altos pontos de fusão e ebulição;
a) duros, mas pouco tenazes;
b) conduzem corrente elétrica dissolvidos em água ou no estado líquido (fundidos);
. seu melhor solvente é a água.
b) conduzem corrente elétrica dissolvidos em água ou no estado líquido (fundidos);
. seu melhor solvente é a água.
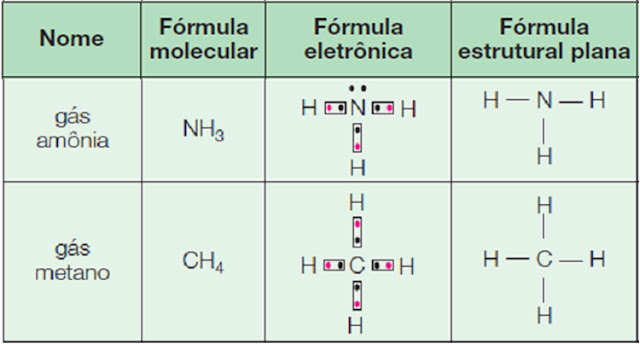
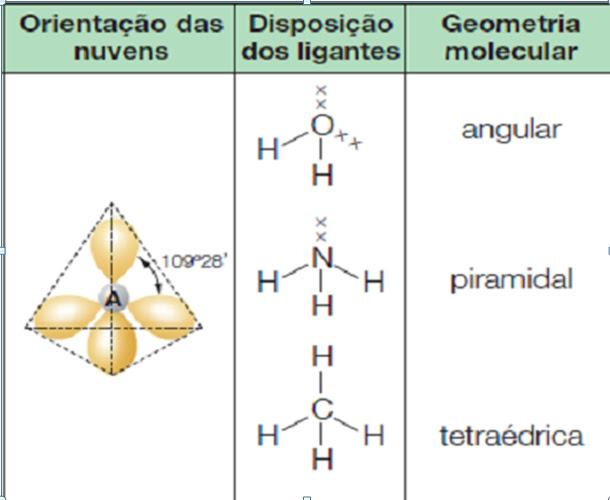
Ligação Covalente ou molecular
Ocorre com compartilhamento de elétrons em elementos que tem tendência a ganhar elétrons: Ametal, semimetal e hidrogênio.
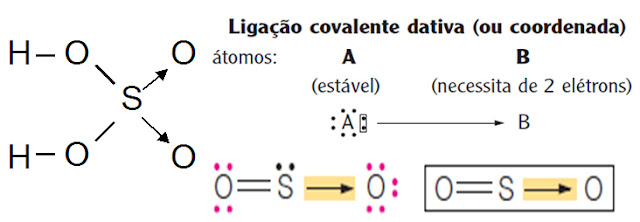
Ligação Covalente Dativa
Ocorre quando um dos átomos já adquiriu estabilidade e outro ainda precisa de um par de elétrons.
Exemplos: SO2, SO3, O3
Ácidos oxigenados: H2SO4, HBrO3, H3PO4
Propriedades dos compostos covalentes ou moleculares
a) baixos pontos de fusão e ebulição se comparados aos iônicos;
Exceção: macromoléculas
b) Não conduzem corrente elétrica.
Exceção: sílica e grafite
c) podem existir nos três estados físicos:
hidrogênio – gasoso; água – líquido; sacarose – sólido.
Ligações metálicas
• Ligas metálicas
• Metal ligado a outro elemento mantendo as propriedades gerais de metal, geralmente para
aumentar tenacidade ou dureza ou diminuir a oxidação.
43 (UNICAP) Assinale as alternativas em verdadeiras ou falsas:
0 0 Ne(g) – ligação covalente
1 1 Na(s) – ligação metálica
2 2 Ge(s) – ligação covalente
3 3 RbCl(s) – ligação iônica
4 4 H2O(s) – formação de pontes de hidrogênio
44. (UNICAP) Considere três substâncias X, Y e Z. A substância X tem alto ponto de fusão e em solução aquosa é boa condutora de corrente elétrica. A substância Y é líquida à temperatura ambiente e não é condutora de corrente elétrica. A substância Z é monoatômica e gás à temperatura ambiente.
Assinale as alternativas em verdadeiras ou falsas:
0 0 A substância X deve apresentar ligações iônicas.
1 1 A substância Y deve apresentar ligações covalentes.
2 2 A substância X deve ser gás a temperatura ambiente.
3 3 A substância Z pode formar interações de Van Der Waals.
4 4 A substância X, no estado sólido é boa condutora de corrente elétrica.
45. (UFSM-2001) Assinale verdadeira (V) ou falsa (F) em cada uma das seguintes afirmativas:
0 0 Em condições ambientes, os compostos iônicos são sólidos que têm pontos de fusão altos.
1 1 Nos compostos covalentes, a ligação ocorre por compartilhamento de elétrons entre os átomos.
2 2 A condutividade elétrica dos metais se explica pela mobilidade dos elétrons na sua superfície.
3 3 As ligações iônicas ocorrem entre átomos de eletronegatividade semelhantes.
0 0 Ne(g) – ligação covalente
1 1 Na(s) – ligação metálica
2 2 Ge(s) – ligação covalente
3 3 RbCl(s) – ligação iônica
4 4 H2O(s) – formação de pontes de hidrogênio
44. (UNICAP) Considere três substâncias X, Y e Z. A substância X tem alto ponto de fusão e em solução aquosa é boa condutora de corrente elétrica. A substância Y é líquida à temperatura ambiente e não é condutora de corrente elétrica. A substância Z é monoatômica e gás à temperatura ambiente.
Assinale as alternativas em verdadeiras ou falsas:
0 0 A substância X deve apresentar ligações iônicas.
1 1 A substância Y deve apresentar ligações covalentes.
2 2 A substância X deve ser gás a temperatura ambiente.
3 3 A substância Z pode formar interações de Van Der Waals.
4 4 A substância X, no estado sólido é boa condutora de corrente elétrica.
45. (UFSM-2001) Assinale verdadeira (V) ou falsa (F) em cada uma das seguintes afirmativas:
0 0 Em condições ambientes, os compostos iônicos são sólidos que têm pontos de fusão altos.
1 1 Nos compostos covalentes, a ligação ocorre por compartilhamento de elétrons entre os átomos.
2 2 A condutividade elétrica dos metais se explica pela mobilidade dos elétrons na sua superfície.
3 3 As ligações iônicas ocorrem entre átomos de eletronegatividade semelhantes.



















 Posted in:
Posted in: 



